大腸がんのステージ
大腸がんのステージ:その意味と重要性
- 大腸がんのステージとは何か、そしてなぜ重要なのか
- TNM分類とは:ステージ分類の枠組み
- ステージ0(上皮内がん):最も早期の兆候
- ステージI:腫瘍は成長するがリンパ節へは転移していない
- ステージII:さらに深く浸潤するがリンパ節転移はなし
- ステージIII:リンパ節への転移が始まる
- ステージIV:転移性大腸がんの解説
- インフォグラフィック:大腸がんのステージ進行の概要
- 治療計画におけるステージの役割
- ステージ診断に使われる画像診断技術
- 手術後に行われる再ステージングと病理検査
- ステージ別の最新生存率データ
- 再発大腸がんの理解
- ステージ分類と治療における遺伝子マーカーの役割
- 若年層と高齢者における大腸がんの違い
- ステージごとの心理的・感情的影響
- 医師とのコミュニケーション:ステージについて話す方法
- セカンドオピニオンを求めるべき時とは
- 初回治療後の長期モニタリング
- ステージごとの臨床試験:知っておくべきこと
- よくある質問
大腸がんのステージとは何か、そしてなぜ重要なのか
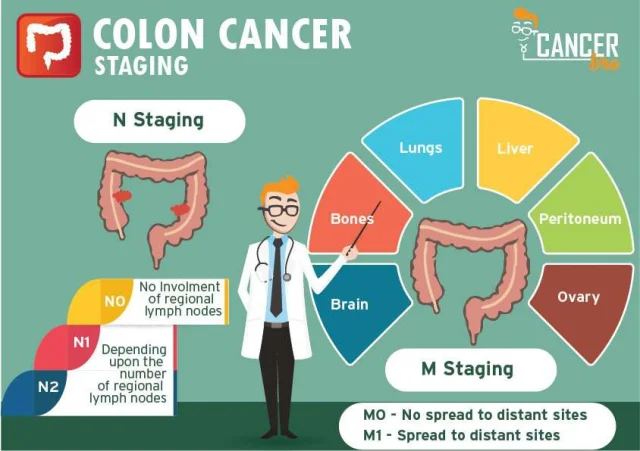
大腸がんと診断されたとき、最初に尋ねられることの1つが「ステージはいくつか?」です。がんのステージは、病気がどれだけ進行し、大腸内や他の臓器にどの程度広がっているかを示します。これは治療法の決定や予後の予測において極めて重要な情報を提供します。
ステージは次の要因に基づいて決定されます:
- 腫瘍の大きさと深さ(大腸壁への浸潤の深さ)
- リンパ節への転移の有無
- 遠隔臓器への転移の有無
医師はステージ情報を用いて以下のことを行います:
- 適切な治療法(手術、化学療法など)の選定
- 予後(生存率など)の見積もり
- 臨床試験の適応可否の判断
正確なステージ判定は、生検または手術後の病理検査によって行われ、CTスキャンや大腸内視鏡検査などの画像診断が補助的に用いられます。
TNM分類とは:ステージ分類の枠組み
大腸がんは、米国がん合同委員会(AJCC)が策定したTNM分類でステージ分けされるのが一般的です。これはがんの特徴を以下の3つの要素に分けて評価します:
| 要素 | 説明 | 大腸がんの例 |
| T(Tumor) | 腫瘍の深さ | T1 = 粘膜内、T4 = 漿膜突破 |
| N(Nodes) | リンパ節転移の有無 | N0 = 転移なし、N1 = 1〜3個、N2 = 4個以上 |
| M(Metastasis) | 遠隔転移の有無 | M0 = 転移なし、M1 = 転移あり |
T・N・Mの組み合わせにより、ステージ0(極早期)からステージIV(進行・転移)までのステージが決定されます。この分類は世界中で広く使われ、治療方針の一貫性を保つための基準となっています。
ステージ0(上皮内がん):最も早期の兆候
ステージ0は大腸がんの中で最も早期かつ治癒が期待できる段階であり、「上皮内がん(carcinoma in situ)」とも呼ばれます。腫瘍は大腸の内側(粘膜)にとどまり、他の層へは浸潤していません。
| 特徴 | 内容 |
| 腫瘍の浸潤 | 粘膜層のみに限定 |
| リンパ節転移 | なし |
| 遠隔転移 | なし |
| 治療法 | 局所切除またはポリープ切除 |
| 5年生存率 | ほぼ100% |
この段階のがんは、通常、定期的な大腸内視鏡検査で発見されます。腫瘍が粘膜に限定されているため、外科的切除のみで化学療法を行わずに治癒するケースが多くあります。
ステージI:腫瘍は成長するがリンパ節へは転移していない
ステージIでは、腫瘍が大腸壁の内部層に浸潤していますが、リンパ節や他の臓器への転移はありません。
| 特徴 | 説明 |
| T分類 | T1またはT2(粘膜下層または筋層への浸潤) |
| N分類 | N0(リンパ節転移なし) |
| M分類 | M0(遠隔転移なし) |
| 主な治療法 | 外科手術(部分的な結腸切除) |
| 予後 | 非常に良好、5年生存率は90%以上 |
この段階では、がんが高リスクでない限り、化学療法は通常必要ありません。ステージIは、ポリープやスクリーニングで発見された腫瘤を手術で切除した後に確定診断されることが多いです。
ステージII:さらに深く浸潤するがリンパ節転移はなし
ステージIIの大腸がんは、腫瘍が大腸の外層や周囲の組織まで浸潤している状態を指します。ただし、リンパ節への転移はまだ確認されていません。
このステージには3つのサブステージがあります(IIA、IIB、IIC)。
| 特徴 | 内容 |
| リンパ節転移 | N0(転移なし) |
| 遠隔転移 | M0(転移なし) |
| 主な治療法 | 外科手術 ± 補助的化学療法 |
| リスク因子の考慮 | 分化度が低い、腸閉塞などの併発症 |
このステージでは、手術が主な治療手段となりますが、高リスク因子がある場合(たとえば穿孔、高悪性度組織像など)には、術後に化学療法が推奨されることもあります。特にステージIIAでは予後が良好とされます。
ステージIII:リンパ節への転移が始まる
ステージIIIの大腸がんでは、腫瘍が小さくても近隣のリンパ節への転移が確認されます。これはステージ分類の中で重要な転換点であり、リンパ節への転移は予後や治療戦略に大きく影響します。
| 特徴 | 内容 |
| 治療法 | 外科手術+補助的化学療法 |
| 一般的な化学療法 | FOLFOXまたはCAPOX |
| 5年生存率 | 53〜89%(転移したリンパ節の数により異なる) |
リンパ節の転移数(N1とN2)は再発リスクに大きく影響します。ステージIIIでは、局所的な外科手術だけでなく、全身療法(化学療法)が標準治療となります。
ステージIV:転移性大腸がんの解説
ステージIVは、がんが肝臓、肺、腹膜、または遠隔リンパ節などの他の臓器に転移している状態です。最も進行したステージですが、近年の治療の進歩により生存率が大きく改善されています。
| 特徴 | ステージIVA | ステージIVB | ステージIVC |
| 遠隔転移 | 1カ所の臓器(例:肝臓) | 2カ所以上の臓器 | 腹膜+他の臓器 |
| リンパ節転移 | いずれも可 | いずれも可 | いずれも可 |
| 治療法 | 化学療法 ± 標的治療 | 手術やアブレーションを含むことも | 緩和治療 + 免疫療法臨床試験 |
| 平均生存期間(2024年データ) | 30〜36ヶ月(反応良好時) | 15〜30ヶ月 | 12ヶ月未満(非反応時) |
ステージIVの大腸がんは一般的に治癒困難とされますが、肝臓や肺の転移が限られている患者の一部では、積極的な治療により長期寛解が可能です。この分野は現在も活発に研究が進められており、多くの臨床試験が実施されています。
インフォグラフィック:大腸がんのステージ進行の概要
以下は、大腸がんがどのように進行するかを視覚的に簡略化した表です:
| ステージ | 浸潤範囲 | リンパ節 | 遠隔転移 |
| ステージ0 | 粘膜層のみ | なし | なし |
| ステージI | 筋層まで | なし | なし |
| ステージII | 大腸の深層または周囲の組織 | なし | なし |
| ステージIII | 任意の腫瘍+リンパ節転移 | あり | なし |
| ステージIV | 任意の腫瘍+遠隔転移 | あり/なし | あり |
この図は、初めて大腸がんのステージ分類に触れる患者にとって、理解を助ける手段となります。それぞれのステージが治療と生存計画においていかに重要かがよく分かります。
治療計画におけるステージの役割
大腸がんのステージは、生存率の予測だけでなく、治療アプローチを直接的に決定する重要な要素です。早期のがんは通常、手術のみで治療されますが、進行がんでは化学療法、放射線療法、または分子標的療法が必要になることが多くなります。
| ステージ | 標準的な治療 | 補足情報 |
| ステージ0 | ポリープ切除または局所切除 | 化学療法は不要 |
| ステージI | 外科的切除 | 補助療法はまれ |
| ステージII | 外科手術 ± 化学療法 | 危険因子(例:腸閉塞)に基づく |
| ステージIII | 手術+化学療法(FOLFOX/CAPOX) | リンパ節転移数により治療強度が決定 |
| ステージIV | 化学療法 ± 手術 ± 分子標的薬 | 転移部位により治療方針が複雑化 |
治療方針は、外科医、腫瘍内科医、放射線科医、病理医などからなる多職種チーム(カンファレンス)によって個別に決定されることも多いです。
ステージ診断に使われる画像診断技術

正確なステージ判定には、放射線画像と病理検査の両方が必要です。手術前後に行われるさまざまな画像診断によって、腫瘍の大きさ、リンパ節転移、遠隔転移の有無を評価します。
| 画像診断 | 役割 | 一般的な使用場面 |
| CTスキャン(腹部/骨盤) | 遠隔転移やリンパ節腫大の検出 | 手術前の基礎評価 |
| MRI | 直腸への浸潤や肝病変の評価 | 詳細な局所・肝臓評価 |
| PET-CT | 活動性病変や再発の確認 | 進行期や転移部不明の場合 |
| 内視鏡的超音波(EUS) | 腫瘍の浸潤深度評価 | 主に直腸がんに使用 |
これらの検査は、ステージ分類の正確性を高め、最適な治療戦略の構築に役立ちます。
手術後に行われる再ステージングと病理検査
大腸がんの手術後には、切除された組織が病理検査に回され、臨床的に診断されたステージが再評価されます。このプロセスは「再ステージング(restaging)」と呼ばれます。
| 手術結果 | ステージへの影響 |
| 多数のリンパ節が発見された場合 | N0 → N1/N2へアップステージ |
| 予期せぬ組織浸潤 | T分類の上昇の可能性あり |
| 切除縁が陰性(クリア) | 完全切除が確認される |
| 血管・リンパ管浸潤の有無 | 再発リスクの指標となる |
また、病理検査では、MSI(マイクロサテライト不安定性)やKRAS/NRAS変異などの分子マーカーの有無も確認され、治療計画と予後予測に役立ちます。
ステージ別の最新生存率データ
大腸がんの生存率は、診断時のステージに強く依存します。早期がんでは非常に高い生存率が得られますが、進行がんでも全身治療の進化により生存率は改善傾向にあります。
| ステージ | 5年生存率(米国SEERデータ) |
| ステージ0 | 約99% |
| ステージI | 約90〜95% |
| ステージII | 約75〜87% |
| ステージIII | 約53〜89%(リンパ節数により異なる) |
| ステージIV | 約14%(治療により改善傾向) |
生存率には年齢、腫瘍の遺伝子型、手術の成功度、先進治療へのアクセスの有無なども影響します。最近ではステージIVであっても、適切な治療により長期間生存する例が増加しています。
再発大腸がんの理解
治療が成功した後でも、大腸がんが再発することがあります。これを「再発がん」と呼びます。再発は、元の腫瘍の周囲(局所)、近くのリンパ節(領域性)、あるいは遠隔臓器に発生する可能性があります。再発のリスク評価にもステージ分類が重要な役割を果たします。
| 再発の種類 | 説明 | よく見られる部位 |
| 局所再発 | 元の腫瘍部位の近くにがんが戻る | 結腸の手術部位 |
| 領域再発 | 近くのリンパ節に再発が起きる | 腸間膜リンパ節、骨盤リンパ節 |
| 遠隔再発 | 他の臓器に転移が現れる | 肝臓、肺、腹膜など |
再発が疑われる場合は、再びステージ判定が行われ、必要に応じて再手術、放射線治療、または全身療法が検討されます。ステージごとに監視の頻度や検査内容が異なり、リスクの高い患者は6〜12か月ごとに画像検査や大腸内視鏡検査を受けることがあります。
ステージ分類と治療における遺伝子マーカーの役割

近年の大腸がん治療では、分子プロファイリング(遺伝子解析)がステージ分類や治療方針の決定に取り入れられています。これらの遺伝子変異はTNM分類そのものには影響しませんが、予後や使用する治療薬の選定に大きな影響を与えます。
| 遺伝子マーカー | 大腸がんにおける意義 | 治療上の関連性 |
| MSI(マイクロサテライト不安定性) | 早期ステージでの良好な予後を示す | 5-FUに対する効果が低い可能性 |
| KRAS/NRAS変異 | 約40%の腫瘍で見られる | EGFR阻害剤の効果がない |
| BRAF変異 | 不良な予後と関連 | 複数の薬剤併用が推奨される場合あり |
| p53 / APC遺伝子喪失 | 一般的な腫瘍抑制遺伝子変異 | 研究段階ではあるが重要性が高まっている |
特にステージIIの患者でMSIが高い場合、化学療法を回避できる可能性があり、また特定の変異がある患者のみが標的治療薬の対象になります。
若年層と高齢者における大腸がんの違い
大腸がんは通常50歳以降に多く見られますが、近年では45歳未満の若年層での発症も増加しています。若年患者では進行ステージでの発見が多く、腫瘍がより攻撃的な傾向があります。
| 特徴 | 若年層(<45歳) | 高齢者(>65歳) |
| 初診時のステージ | 進行期での発見が多い | 定期スクリーニングにより早期発見が多い |
| 腫瘍の性質 | 粘液性や印環細胞など攻撃的な形態 | 標準的な腺がんが多い |
| 家族歴 | 多く見られる | 少ない傾向 |
| スクリーニングの機会 | 年齢制限により受診が少ない | Medicare等を通じて受診機会あり |
このため、若年層では遺伝子カウンセリングや、より綿密なフォローアップが重要です。直腸出血や原因不明の体重減少などの症状は、年齢にかかわらず早期に医師の診察を受けるべきです。
ステージごとの心理的・感情的影響
がんのステージは、医学的な戦略を決定するだけでなく、患者が診断をどう受け止めるかにも大きく影響します。ステージIでは安心感や希望が得られる場合がある一方、ステージIVではショックや不安、絶望感が強くなることもあります。
| ステージ | 主な感情的反応 | 利用可能な支援 |
| ステージI–II | 安心感、再発への不安、フォローアップの不明確さ | サバイバー支援クリニック、ピアサポート |
| ステージIII | 抗がん剤に伴うストレス、ライフスタイルの変化 | がん専門のソーシャルワーカー、カウンセリング |
| ステージIV | 悲嘆、抑うつ、革新的治療への希望 | 緩和ケア、メンタルヘルスサポート |
心理的サポートの早期介入は、ステージに関係なくQOL(生活の質)や治療への取り組みに大きく貢献します。
医師とのコミュニケーション:ステージについて話す方法
大腸がんのステージを理解するのは簡単ではありません。納得のいく決断を下すためには、がん治療チームとの明確なコミュニケーションが欠かせません。質問すべき内容を知っておくことで、状況をよりよく把握し、自信を持って対処できるようになります。
| 話し合う項目 | 確認・質問する内容 |
| ステージの分類 | 「私のステージはどういう意味ですか?できるだけわかりやすく説明してもらえますか?」 |
| 画像診断や生検の結果 | 「このステージを確定した検査は何ですか?他に検査が必要ですか?」 |
| 治療の目標 | 「この治療は治癒を目指したものですか?予防的ですか?それとも緩和的ですか?」 |
| セカンドオピニオンの必要性 | 「別の病理医による再確認は可能ですか?」 |
| 分子検査の実施 | 「腫瘍の遺伝子検査はされましたか?治療にどのように影響しますか?」 |
準備を整えて診察に臨むと、医師との対話がスムーズになります。質問をメモして持参し、可能であれば同伴者と一緒に受診することで、より多くの情報を吸収でき、見落としも防げます。
セカンドオピニオンを求めるべき時とは
ステージ判定の誤りは稀ですが、限られた画像診断、病理情報の不足、または腫瘍の解釈の違いにより起こる可能性があります。セカンドオピニオンを求めることで、より正確なステージ診断や、治療の選択肢が広がる場合もあります。
| セカンドオピニオンを求める理由 | 得られる可能性のあるメリット |
| 不明確な画像診断や矛盾する報告 | より高精度な放射線診断 |
| 稀な腫瘍タイプや攻撃的な病理像 | 専門病理医による詳細な評価 |
| 特異な分子的特徴 | 大学病院や臨床試験施設への紹介 |
| 患者の不安や不信感 | 安心感の回復と理解の深化 |
大規模ながんセンターでは、遠隔によるセカンドオピニオンサービスや、多職種によるチーム診断が提供されています。特にステージIIやIVのように、微妙な判定差が治療に影響するケースでは有益です。
初回治療後の長期モニタリング
治療が成功した後でも、再発の早期発見や新たながんの確認のため、継続的なモニタリング(サーベイランス)が必要です。フォローアップの頻度は、初回のステージによって異なります。
| 初回診断時のステージ | フォローアップ頻度(1〜3年目) | 使用される検査ツール |
| ステージI | 6〜12か月ごと | 大腸内視鏡、血液検査 |
| ステージII〜III | 3〜6か月ごと | CTスキャン、CEA検査、大腸内視鏡 |
| ステージIV | 2〜3か月ごと | 画像診断、腫瘍マーカー |
3〜5年以降は、特にステージIやIIの患者では間隔が長くなる傾向があります。ただし、遺伝性疾患や攻撃的ながんの特徴を持つ場合は、長期にわたる定期的な監視が必要とされます。
ステージごとの臨床試験:知っておくべきこと
臨床試験では、まだ一般には利用できない最新の治療法が提供されます。ほぼすべてのステージの患者が対象となり得ます。ステージIの予防的治療から、ステージIVの実験的治療まで、幅広く参加のチャンスがあります。
| ステージ | 主な臨床試験の目的 |
| ステージI〜II | 化学予防、最小限の補助療法 |
| ステージIII | 新しい抗がん剤や免疫療法の組み合わせ |
| ステージIV | 標的療法、生物学的製剤、新規投与法 |
臨床試験は で検索するか、主治医に相談することで紹介されます。試験参加には、遺伝子変異の有無、過去の治療歴、全身状態などの条件があります。ステージIVの患者にとっては、生存率の向上やQOL改善につながる貴重な選択肢となることもあります。
よくある質問
大腸がんは早期に発見されれば完治しますか?
はい。ステージ0またはステージIの段階で発見された大腸がんは、外科的切除だけで完治することが多く、5年生存率は90%以上に達します。これらの初期段階では、腫瘍は粘膜層や浅層にとどまっており、リンパ節や他の部位への転移がありません。ただし、将来的な変化や新たなポリープ形成を早期に発見するために、継続的なフォローアップは不可欠です。
大腸がんにおけるCEA血液検査とは何ですか?
CEA(癌胎児性抗原)は、大腸がん患者、特に進行がんで高くなることがあるタンパク質です。スクリーニングや診断には適していませんが、治療後の再発チェックや治療反応のモニタリングに広く使われています。手術や化学療法後にCEA値が上昇した場合は、再発を疑って追加検査が行われることがあります。
ステージIからステージIVまで進行するのにどれくらいかかりますか?
進行速度は、腫瘍の性質、遺伝要因、免疫応答、環境要因によって個人差があります。一般的には、ステージIからステージIVに進行するには数年かかることが多く、この進行の遅さが定期的なスクリーニングと早期発見の重要性を示しています。
リンパ節に転移がなくても大腸がんは広がることがありますか?
はい。リンパ節転移が最も一般的な転移経路ですが、血流を通じて直接遠隔臓器に転移したり、隣接臓器に浸潤する場合もあります。高悪性度の腫瘍や特定の分子型では、リンパ節転移がなくても肝臓などに転移することがあります。
治療後の再発リスクはどのくらいありますか?
再発リスクはステージ、腫瘍の分化度、手術の完全性に依存します。ステージIでは再発率は5%未満と非常に低いですが、ステージIIIやIVでは30〜60%に及ぶこともあります。再発リスクの高い場合は、定期的な検査によって早期発見を目指します。
大腸がんに放射線治療は使われますか?
大腸がんでは放射線治療はあまり一般的ではありません。ただし、隣接臓器へ浸潤している局所進行がんや、特定の再発部位に限定された場合などでは使用されます。解剖学的に直腸がんでは放射線治療がより一般的です。
肥満は大腸がんの予後に影響しますか?
肥満は大腸がんの発症リスクを高めるだけでなく、治療後の予後にも悪影響を及ぼすことがあります。体脂肪の多さは薬剤代謝や免疫応答、腫瘍環境に影響し、手術後の合併症率が上昇する可能性があります。
ステージIVの大腸がんの症状には何がありますか?
ステージIVの大腸がんでは、原因不明の体重減少、慢性疲労、腹部膨満、肝腫大、持続的な痛みなどの全身症状がみられることがあります。転移部位によって、咳(肺転移)、黄疸(肝転移)、腸閉塞なども起こる可能性があります。
治療後10年以上経ってから再発することはありますか?
ほとんどの再発は治療後5年以内に起こりますが、非常にまれに10年以上経ってから再発することもあります。特に遺伝的要因や遺伝性のがん症候群を持つ患者では、生涯にわたって再発リスクが残る可能性があり、長期的なフォローアップが推奨されます。
大腸がんの予防ワクチンはありますか?
現在、大腸がんのために承認された予防ワクチンはありませんが、研究は進んでいます。腫瘍関連抗原や免疫経路を標的にした実験的ワクチンが開発されており、再発防止や治療後の免疫強化を目的としています。
ストレスは大腸がんのリスクを高めますか?
ストレスそのものが大腸がんの発症に直接関与する証拠はありません。ただし、慢性的なストレスは不健康な生活習慣(不適切な食事、運動不足、喫煙、受診の遅れなど)を助長する可能性があり、これが間接的にがんリスクを高める要因になります。診断後のストレスが治療の継続や回復にも影響するため、精神的ケアは重要です。
大腸がんは遺伝しますか?
大腸がんのほとんどは散発的に発生しますが、約5〜10%は遺伝性です。リンチ症候群(HNPCC)や家族性大腸腺腫症(FAP)などの遺伝性疾患では、生涯における大腸がんのリスクが著しく高まります。特に50歳未満での家族の罹患者がいる場合は、遺伝カウンセリングや早期スクリーニングが強く推奨されます。
生活習慣の改善で再発を防ぐことはできますか?
はい。食物繊維を多く含み、赤身肉を控えた食事、適正な体重維持、定期的な運動、喫煙や過度な飲酒の回避は、再発リスクの軽減に役立ちます。これらの改善は全身の健康にも寄与し、免疫機能を高め、化学療法などの治療への耐性も向上します。
結腸がんと直腸がんの違いは何ですか?
結腸がんと直腸がんはともに大腸がんに分類されますが、解剖学的位置、治療法、再発パターンなどに違いがあります。直腸がんは骨盤内に位置しており、放射線治療がより一般的に使用されます。一方、結腸がんは主に外科的切除と全身治療が主体となります。
通常の血液検査で大腸がんを発見できますか?
通常の血液検査(CBCや肝機能検査)では、大腸がんを直接診断することはできません。ただし、貧血などの間接的な兆候が現れることがあります。CEAなどの腫瘍マーカーも補助的に用いられますが、診断には大腸内視鏡検査や画像検査が不可欠です。